RESUME
Présentation et explication du principe thermodynamique
Il s’agit d’un nouveau procédé de pompe à chaleur, consistant à transférer de la chaleur par un gaz entre deux plaques rapprochées, grâce à un champ électrique créé à la surface de la plaque chaude dite « électrostatique » qui polarise et attire les molécules de gaz sur cette plaque, de manière à leur faire céder de l’énergie par accommodation thermique ( (1) schéma ci-dessous). Les molécules se comportent comme si elles entraient en contact avec une plaque plus froide ( (2) schéma ci-dessous).
Cycle thermodynamique
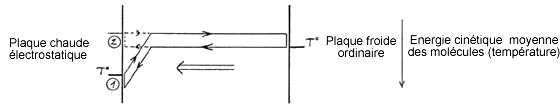
Le transfert de chaleur s’effectue de la plaque ordinaire froide vers la plaque électrostatique chaude,
dans la limite d’une différence de température correspondant à l’accélération des molécules dans le champ d’attraction (schéma 5).
La puissance de transfert thermique
est déterminée par le gradient de température dans la partie du gaz qui n’est pas soumise au champ électrique, c’est à dire la quasi totalité du volume de gaz. Aussi adopte-t-on la formule donnant le courant de chaleur par conduction thermique dans un gaz entre deux plaques de températures différentes, moyennant une modification pour la température de la plaque électrostatique T2’
|
Q = |
l |
T1-T2’ |
|
|
|
d + 2g |
Avec l = conductivité thermique du gaz
d = distance de séparation des plaques
g = 2.7 lpm (libre parcours moyen des molécules dans le gaz).
La raréfaction du gaz n’atténue donc pas la puissance de transfert thermique
par rapport à un gaz à pression atmosphérique, tant que le libre parcours moyen des molécules n’atteint pas la distance entre les plaques. Avec des plaques espacées de 0.1 mm, la puissance de transfert n’est réduite que de 20% pour une pression de 10-2 bar, 75% pour 10-3 bar.
Dans un gaz soumis à un champ d’attraction, comme par exemple le champ de pesanteur terrestre, existe une variation de pression, mais aussi de température, dont le gradient est parallèle au champ d’attraction. Ainsi dans l’atmosphère, la température baisse au fur et à mesure que l’on s’élève en altitude.
Par conséquent, si l’on met en contact thermique deux plaques par l’intermédiaire d’une mince couche de gaz horizontale dans laquelle règne un champ d’attraction très intense , une différence de température va se créer entre les deux plaques, la plaque supérieure cèdera de la chaleur et se refroidira , tandis que la plaque inférieure se réchauffera en absorbant cette chaleur. La chaleur s’écoulera spontanément d’une plaque à l’autre par conduction thermique dans le gaz, c’est à dire sans fournir de travail.
Il consiste à transférer de la chaleur par un gaz entre deux plaques rapprochées de températures différentes, de la plaque froide vers la plaque chaude, grâce à un champ électrique créé à la surface de la plaque chaude dite « électrostatique » qui attire les molécules de gaz pour leur faire céder de l’énergie par accommodation thermique. En pénétrant dans le champ électrique, chaque molécule est attirée et voit son énergie cinétique augmenter, ce qui entraîne une augmentation de la température de la plaque par contact avec les molécules chaudes.
Ec = 3/2KT (pour un gaz monoatomique ou gaz rare)
|
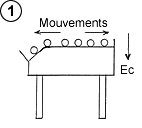
Une manière imagée de se représenter le phénomène escompté consiste à remplacer les molécules de gaz par une multitude de boules de billard en mouvement sur une table, laquelle comporterait un « fossé » à l’un des deux bords (schéma ci-contre). Pour que l’image soit juste, il faut faire abstraction des pertes d’énergie qui tendent à réduire le mouvement, comme par exemple le léger frottement des boules sur le tapis, ainsi que la perte d’énergie dans les chocs (les boules s’échauffent très légèrement dans un choc, d’où une perte globale d’énergie cinétique des boules après un choc). |
On pourrait ainsi constater que l’énergie cinétique moyenne des boules qui frappent le bord gauche, en bas du fossé, est supérieure à l’énergie cinétique moyenne des boules sur la partie horizontale de la table, chaque boule qui pénètre dans le fossé voyant son énergie cinétique augmenter d’une valeur correspondant à l’énergie potentielle de la boule dans cette dénivellation. L’énergie cinétique moyenne pouvant être assimilée à la température, il vient que la température des boules frappant le bord gauche est supérieure à la température des boules frappant le bord droit.
N.B : Conformément à cette représentation, il m’a paru judicieux, sur tous les schémas, d’élever la température vers le bas, un niveau plus bas sur le schéma correspondant à une température plus élevée.
Principe de l’accommodation thermique
Transfert thermique entre deux plaques ordinaires de températures différentes
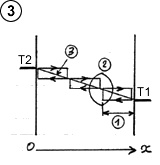
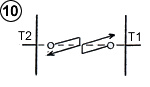
Pour simplifier la représentation, imaginons deux plaques rapprochées de températures différentes, avec du gaz raréfié entre les deux de manière à ce que les molécules oscillent entre les deux plaques généralement sans collision avec d’autres molécules, et observons l’une d’elles, d’abord quand celle-ci se déplace vers la plaque droite ( (1) schéma ci-contre).
(le cycle fléché indique le sens du déplacement de la molécule et son niveau énergétique selon la position sur l’axe Ox entre les plaques. Un trait horizontal signifie seulement que la molécule se déplace à vitesse et énergie constante entre les plaques).
|
|
En arrivant sur la plaque de droite plus chaude, la molécule adapte son énergie cinétique à la température de la plaque, en l’occurrence elle va se réchauffer en rebondissant à une vitesse supérieure après avoir puisé de l’énergie sous forme de chaleur sur la plaque ( (2) schéma ci-contre). Le phénomène est connu sous le nom d’accommodation thermique.
|
Plus précisément, lorsqu’une molécule, à une température Ti, frappe une surface à une température Ts, il y a un échange d’énergie et la molécule est réémise à une température Tr intermédiaire. On définit un coefficient d’accommodation, qui est le rapport de l’énergie moyenne réellement échangée à l’énergie qui serait échangée si les particules réémises atteignaient un équilibre thermique parfait avec la paroi.
|
|
|
|
|
|
Généralement a est compris entre 0,4 et 0,85 .
Le coefficient a dépend surtout de la nature du gaz, il est élevé pour des gaz de masse moléculaire élevée, (ce qui est le cas dans l’invention) (source d’information : Techniques de l’ingénieur B4020)
L’effet inverse se produira au contact de la plaque de gauche plus froide, la molécule rebondissant à une vitesse inférieure après avoir cédé de l’énergie
sous forme de chaleur sur la plaque ( (3) schéma 2). Cet échange multiplié par la fréquence considérable d’aller retours , puisque la vitesse moyenne d’une molécule de gaz est de l’ordre de 400 à 500 m/s, ainsi que la densité considérable de molécules dans un gaz, a pour effet d’égaliser progressivement la température des deux plaques.
Influence de la pression gazeuse sur la puissance de transfert
Avec une pression (ou densité) correspondant à un libre parcours moyen (lpm-parcours sans collision) supérieur à la distance entre les plaques, c’est à dire un gaz raréfié, une petite variation de pression engendre une variation du nombre de « transporteurs d’énergie » que sont les molécules, et par conséquent une variation de la puissance de transfert thermique.
|
|
Pour une
pression correspondant à un libre parcours moyen inférieur à la distance
entre les deux plaques, c’est à dire un gaz dense, des collisions
ont lieu au sein du gaz, et ce d’autant plus que la densité est forte
( le libre parcours moyen dans un gaz d’argon à pression atmosphérique
est de 50 nanomètres, soit 0,05 micron). Comme cela est représenté
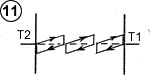
symboliquement sur le schéma ci-contre, ces collisions raccourcissent
les cycles thermodynamiques moléculaires (1) , mais elles tendent
aussi à égaliser l’énergie moyenne des molécules après le rebond (2)
ce qui diminue la différence d’énergie cinétique moyenne, sur un plan
donné entre 0 et x, entre les deux sens de déplacement des molécules.
|
La fréquence des échanges d’énergie contre les parois augmente toujours proportionnellement avec la pression, mais cette augmentation de fréquence est compensée par une diminution de l’énergie échangée par un choc. Pour reprendre l’image des « transporteurs d’énergie », le nombre de transporteurs augmente continuellement avec la pression, mais lorsque le libre parcours moyen est plus petit que la distance entre les plaques, cette augmentation est compensée par une diminution de leur charge, d’où un débit énergétique constant. La puissance de transfert thermique ne varie donc plus avec la pression, ce que confirme la formule suivante :
|
Q = |
l |
T1 – T2 |
|
|
|
d + 2g |
Avec l = conductivité thermique du gaz
T1, T2 = température des plaques
d = distance de séparation des plaques
g = 2,7 lpm pour les gaz lourds
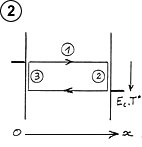
On voit dans cet exemple que la température dans le gaz varierait selon la position sur l’axe Ox entre les plaques, selon un gradient ou une pente thermique ( (3) schéma 3). La représentation symbolique de trois cycles signifie surtout que la température du gaz, comme dans un gaz raréfié, est liée au sens de déplacement des molécules. Mais il serait plus correct, pour représenter la température selon le sens de déplacement, de tracer deux droites parallèles à la pente thermique, car les collisions s’effectuent à tous les niveaux selon l’axe Ox. La séparation en trois cycles juxtaposés suggère que dans un gaz dense les choses se passent comme s’il y avait des cloisons ou des films hyperminces disposés parallèlement aux plaques, le libre parcours moyen correspondant à la distance entre ces cloisons.
Introduction d’un champ d’attraction
|
|
Pour simplifier la démonstration, on reprend
le cas du gaz raréfié.
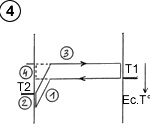
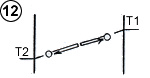
Supposons que la molécule, en parvenant à proximité de la plaque de gauche, dite « électrostatique », pénètre dans un champ d’attraction électrique. Cela se traduit sur la courbe thermo-énergétique par un fossé ( (1) schéma ci-contre) à l’image de la table de billard représentée plus haut. Ce champ d’attraction augmente l’énergie cinétique de la molécule et va la porter à une température supérieure à celle de la plaque (dans la
|
limite d’une différence de température entre les plaques correspondant à l’énergie potentielle du champ d’attraction).
Par accommodation thermique, elle va céder de l’énergie au contact de la plaque (2) et repartir à une vitesse inférieure.
Pour repartir, la molécule doit « remonter » le champ d’attraction, et perdre autant d’énergie cinétique qu’elle en a gagné en « tombant ». Le résultat final est un refroidissement de la molécule (3), bien qu’à l’origine, avant de pénétrer dans le champ d’attraction, elle était plus froide que la plaque qu’elle allait rencontrer. Ce refroidissement sera identique à celui qu’elle aurait subi sur une plaque ordinaire, avec un écart de température identique entre la molécule et la plaque au moment du contact (4).
N.B : Il convient à présent de noter que, l’énergie potentielle du champ d’attraction n’étant équivalente qu’à une petite fraction de l’énergie cinétique moyenne des molécules (quelques dizaines de degrés au mieux, comparé à la température ambiante qui est d’environ 300 Kelvins), elles ont très peu de chance d’être piégées et n’ont pas besoin de récupérer de l’énergie thermique sur la plaque pour sortir du champ d’attraction, ce qui bien entendu annulerait l’effet escompté. Pour prendre une comparaison, une voiture passant dans un nid de poule n’est pas que légèrement freinée, et n’a pas besoin de la puissance du moteur pour en sortir.
|
|
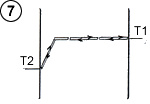
L’échange énergétique décrit plus haut tend à réchauffer la plaque électrostatique et à refroidir la plaque ordinaire, jusqu’à ce que l’écart de température entre les plaques atteigne une valeur correspondant à l’énergie potentielle du champ d’attraction. L’équilibre thermodynamique est atteint lorsque l’énergie moyenne des molécules, au contact de chaque plaque, correspond à la température respective des plaques (schéma ci-contre). Dans ce cas, il n’y a globalement plus d’accommodation thermique, et donc plus de transfert thermique. Cette situation correspond à la configuration « table de billard », où les boules rebondissent sur les parois en conservant leur énergie cinétique. Avec une pression plus forte (ou gaz plus dense), le principe fondamental reste inchangé, si ce n’est que les molécules, une fois sorties du champ d’attraction et refroidies, reprennent de l’énergie par collisions intermoléculaires plutôt que sur la plaque froide. Le processus d’échange énergétique en dehors du champ d’attraction demeure identique à celui entre deux plaques ordinaires, avec une température variant sur l’axe Ox selon un gradient ou une pente thermique ( (3) schéma ci contre) qui détermine par ailleurs la puissance de transfert thermique. Ainsi, lorsque la pente thermique dans cette zone est plate, l’équilibre thermodynamique est atteint, et la puissance de transfert s’annule (schéma 7). D’après ce schéma, le gaz régnant dans le champ d’attraction (contre la plaque électrostatique) serait en équilibre thermodynamique malgré la variation de température, et malgré les collisions intermoléculaires dans cette zone. Pour, s’en convaincre, il faut examiner les conditions dans lesquelles l’équilibre s’établit.
Comme on l’a vu sur les figures 3 et 6, les collisions tendent à égaliser l’énergie moyenne des deux sens de déplacement des molécules. Si l’on considère à un moment donné l’ensemble des molécules se trouvant sur un plan parallèle aux plaques, compris entre 0 et x, les molécules se déplaçant vers la gauche ont une énergie moyenne plus élevée que celles se déplaçant vers la droite, mais cette différence tend à s’annuler pour ce qui concerne les molécules qui viennent d’entrer en collision (schéma ci-contre).
L’équilibre thermodynamique s’établit lorsque les molécules ont une énergie moyenne identique dans les deux sens de déplacement, c’est à dire lorsqu’il n’y a plus d’échange global d’énergie dans les collisions. Dans ce cas, tout le gaz est à température uniforme, l’énergie moyenne des molécules est la même partout (schéma ci-contre).
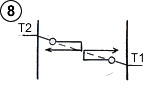
Si l’on introduit maintenant un champ d’attraction, les molécules se déplacent avec une énergie variable et non plus constante comme dans les cas précédents (ce qui est caractérisé par les flèches en pente). Dans le cas schématisé ci-contre où la température est uniforme dans le gaz, les molécules acquièrent ou perdent de l’énergie pendant leur trajet, et par conséquent elles se rencontrent avec une énergie différente, d’où un échange global d’énergie dans les collisions. Le gaz n’est pas en équilibre thermodynamique
Pour reprendre le modèle de la figure 3, l’échange thermique entre les deux plaques se produirait comme représenté sur le schéma ci-contre.
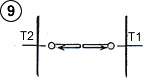
L’équilibre thermodynamique s’établit lorsque les molécules se déplaçant de chaque côté ont une énergie moyenne identique au moment du choc. Dans ce cas, il n’y a plus d’échange global d’énergie dans les collisions, bien que la température ne soit pas uniforme dans le gaz (schéma ci-contre).
Nous avons un exemple naturel de gaz en équilibre thermodynamique bien que sa température ne soit pas uniforme, c’est l’atmosphère. En effet, la température et la pression baissent lorsque l’on s’élève en altitude, d’environ 6°C pour 1000 mètres. C’est le champ d’attraction de la pesanteur qui est à l’origine de cette variation de température et de pression. Les masses d’air se compressent et se réchauffent en descendant, ou bien se détendent et se refroidissent en montant. Le principe de l’invention consiste en fait à créer un champ de pesanteur très puissant de manière à obtenir une différence de température suffisante sur une très petite distance, et l’on peut considérer que la plaque électrostatique chaude est la plaque basse altitude, tandis que la plaque ordinaire froide est la plaque haute altitude. |
Puissance de transfert thermique
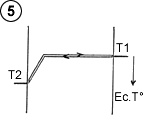
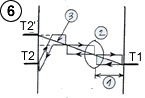
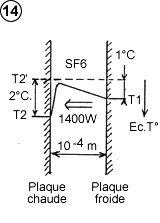
Pour calculer la puissance de transfert thermique (courant de chaleur), on reprendra la formule utilisée avec deux plaques ordinaires, moyennant une adaptation pour la température de la plaque électrostatique. En effet, ce n’est pas la température réelle de la plaque électrostatique qu’il faut considérer, mais la température au delà du champ d’attraction (T2’ – voir schéma 6), qui avec T1, définit le gradient de température dans l’espace gazeux en dehors du champ d’attraction. T2’ est égal à la température réelle de la plaque (T2) à laquelle on soustrait la différence de température correspondant à l’énergie potentielle du champ d’attraction.
|
Q = |
l |
T1 – T2’ |
|
|
|
d + 2g |
|
Imaginons le cas de deux plaques séparées de 0.1 mm (10-4 m), et un champ d’attraction équivalent à 2°C. (l’exemple est volontairement modeste pour bien montrer la potentialité du procédé). En équilibre thermique, c’est à dire lorsque la pente thermique est plate en dehors du champ d’attraction (T1 – T2’ = 0), la plaque électrostatique serait plus chaude que la plaque ordinaire de 2°C. En réduisant de 1°C cet écart de température, on redresse d’1°C la pente thermique, donc T1 – T2’ = 1°C. Si le gaz utilisé est de SF6, dont la conductivité thermique est l = 0,14 W / m.k, et en négligeant 2g si g est petit devant d, le courant de chaleur par mètre carré serait :
|
Avec des plaques séparées de 0,01 mm (10 microns), ce qui est envisageable, et un champ d’attraction équivalent à 20°C, on aurait 140 KW / m² !