|
|
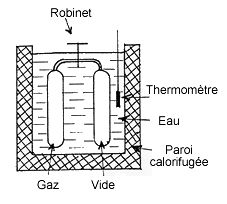
Il s’agit d’une expérience dans laquelle on laisse se détendre un gaz d’un compartiment à un autre, reliés par un orifice étroit comme indiqué sur le schéma ci-contre. Quelques instants après que le gaz soit réparti dans les deux compartiments, on mesure la température et on la compare avec ce qu’elle était avant.
|
Gaz parfait :
On constate qu’elle reste inchangée pour un gaz parfait, dans lequel n’intervient pas d’attraction intermoléculaire (interactions de Van der Waals). Ceci se comprend par le simple fait qu’aucune énergie n’est libérée à l’extérieur du système, contrairement à ce qui se produit dans un moteur où le gaz cède de l’énergie au piston, qui la convertit en travail.
Gaz imparfait :
Il n’en est pas de même avec un gaz imparfait où l’on constate un refroidissement après la détente, lequel est dû à l’augmentation du volume occupé qui éloigne les molécules les unes des autres. En effet, lorsque deux molécules d’un tel gaz s’approchent suffisamment l’une de l’autre, elles s’attirent mutuellement, elles tombent sur elles-mêmes comme dans un trou et voient leur énergie cinétique, donc leur température, augmentée. Par conséquent, lorsque le gaz se détend, le libre parcours moyen des molécules augmente et les molécules « tombent » moins fréquemment, leur niveau moyen d’énergie cinétique est moins élevé et le gaz est moins chaud.
Attracteurs naturels et artificiels
Les molécules se comportent entre elles comme des attracteurs. On voit ainsi que l’on pourrait faire varier la température du gaz si l’on pouvait diminuer ou augmenter le rôle de ces attracteurs, c’est à dire faire varier la fréquence des interactions. On ne peut pas faire en sorte que les molécules se rencontrent plus ou moins souvent, par contre on peut rajouter des attracteurs artificiels. L’invention repose exactement sur ce principe. En fixant des attracteurs à la surface d’une paroi, qui peuvent être une grille métallique chargée comme dans la configuration expérimentale, des ions, un mélange de très fines particules de deux potentiels de surface différents, ou encore une surface microporeuse, on augmente l’énergie des particules qui viennent frapper la paroi et on la chauffe.
Certains m’ont dit que mon procédé ressemblait à celui basé sur une diode vide, dans laquelle une cathode à très faible potentiel d’extraction se refroidit sous l’effet de l’émission des électrons, et ne voyaient pas très bien pourquoi le présent procédé consommerait moins d’énergie.
Dans les deux procédés, on retrouve en effet des particules qui transfèrent de l’énergie d’une plaque froide à une plaque chaude qui lui fait face, grâce à une force d’accélération des particules. Dans la diode à vide, ce sont des particules chargées (électrons) accélérées par un champ électrique. Dans le présent procédé, ce sont des particules électriquement neutres (molécules de gaz) qui se polarisent en pénétrant dans un champ électrique localisé à la surface de la plaque dite « électrostatique », et qui de ce fait sont attirées vers la plaque.
Pourquoi n’y a t-il plus d’énergie consommée avec ce principe d’accélération ?
En effet, dans un dispositif idéal où l’isolation électrique serait parfaite, ou bien dans une configuration où l’on produit un champ électrique sans générateur, une molécule se polarise et se laisse attirer dans le champ électrique mais, après avoir frappé la plaque et cédé de l’énergie par accommodation thermique, elle rebondit, se dépolarise en sortant du champ électrique et par conséquent ralentit en subissant la même énergie d’attraction. Il n’y a donc plus d’énergie globalement dépensée (W=0 – Se souvenir de l’image du ballon tombant sur une planète, mentionnée plus haut). Le seul effet recherché est que la molécule sorte du champ électrique avec une énergie cinétique inférieure à celle qu’elle avait avant de pénétrer dans le champ électrique, comme si elle frappait une plaque ordinaire froide.
Par contre, dans la diode à vide le transfert de chaleur d’une plaque à l’autre est conditionné par l’accélération des électrons de la cathode froide vers l’anode chaude.
Le travail d’accélération des électrons de la cathode vers l’anode est rendu nécessaire par le fait que la cathode froide émet plus difficilement des électrons que l’anode chaude. En effet, le courant électrique ne peut circuler librement (sans résistance) qu’à la condition que les deux électrodes soient à la même température. Dès que la cathode est plus froide que l’anode, elle émet plus difficilement des électrons que l’anode, de telle sorte qu’il y aurait un retour d’électrons de l’anode vers la cathode si on supprimait le champ électrique accélérateur (c’est le principe d’un générateur thermoionique). Il faut donc compenser cette « difficulté » d’émission de la cathode par l’accélération des électrons vers l’anode.
On peut faire une analogie simple avec une pompe à compression mécanique en remplaçant la cathode par l’évaporateur, et l’anode par le condenseur (voir schémas ci-dessous). Lorsque l’évaporateur et le condenseur sont à la même température, on peut faire circuler librement (sans résistance) de la vapeur d’un compartiment à l’autre. De ce flux de vapeur va résulter qu’il y a dans
l’évaporateur un nombre plus important de molécules qui s’évaporent (que de molécules qui se condensent ) et dans le condenseur un nombre plus important de molécules qui se condensent (que de molécules qui s’évaporent). L’évaporateur va donc se refroidir et le condenseur se réchauffer. Dès lors, les molécules s ‘évaporent plus difficilement dans l’évaporateur froid, de telle sorte qu’ il y aurait un retour de vapeur du condenseur vers l’évaporateur si on libérait le passage entre les deux compartiments (c’est le principe du moteur thermodynamique). Il faut donc « accélérer » les molécules vers le condenseur, ce qui signifie en pratique qu’il faut créer une dépression dans l’évaporateur grâce à une pompe.
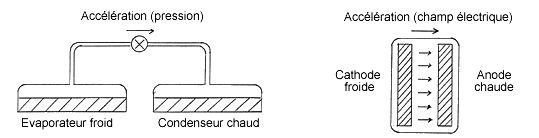
Le présent procédé ne rentre plus dans ce schéma. La grande différence avec tous les procédés existant peut s’exprimer de la manière suivante : le fluide de travail, en l’occurrence du gaz polarisable, SF6 ou autre, ne subit plus de cycle de changements d’états thermodynamiques. Par exemple, dans la pompe à compression mécanique le fluide s’évapore dans l’évaporateur froid, puis se liquéfie dans le condenseur chaud. La température, la pression et l’état de la matière sont changés en changeant de compartiment. Idem pour la diode à vide : le fluide électronique « s’évapore » à la cathode froide, puis « se condense » à l’anode chaude. La température, mais aussi la « pression électronique » s’élèvent en passant de la cathode à l’anode. Le fluide électronique subit donc un changement d’états thermodynamiques.
Dans le présent procédé, il n’y a plus de tel cycle de changements d’états thermodynamiques, par contre plusieurs états thermodynamiques coexistent dans le gaz, la pression et la température étant plus élevées contre la plaque électrostatique, de même que dans l’atmosphère, la pression et la température diminuent au fur et à mesure que l’on s’élève en altitude. Le gaz peut être en équilibre thermodynamique malgré ces différences de température et de pression. Dans le procédé, le transfert de chaleur provient du déséquilibre thermodynamique que l’on crée dans le gaz en réduisant la différence de température entre les plaques par rapport à celle que l’on aurait du seul fait du champ d’attraction. Cette réduction peut se faire, par exemple, en refroidissant la plaque chaude ou en réchauffant la plaque froide (ou les deux à la fois).
Il convient de remarquer aussi que si les particules ne subissent plus collectivement un cycle de changements d’états, il subsiste un cycle individuel ou moléculaire qui remplit exactement la même fonction. C’est à dire qu’on ne peut plus suivre un groupe de particules dont la pression et la température augmentent dans un compartiment, éventuellement avec un changement d’état de la matière, puis retournent à l’état initial dans un autre compartiment, etc ; mais, chaque
molécule de gaz située entre les plaques effectue à tout instant une phase ou une autre d’un cycle dit moléculaire, en totale indépendance par rapport aux molécules voisines telle molécule étant accélérée en pénétrant dans le champ électrique, pendant que telle autre cède de l’énergie par accommodation thermique sur la plaque chaude, pendant que telle autre ralentit en sortant du champ électrique, ou encore pendant que telle autre reprend de l’énergie par accommodation thermique sur la plaque froide. Toutes les phases du cycle s’effectuent en même temps sans qu’il soit possible de détecter un mouvement macroscopique, comme cela l’était dans tous les procédés existant jusqu’ici.