RESUME
Explication du principe électrostatique.
L’attraction de molécules par polarisation est connue dans le phénomène d’électrostriction. Elle est par ailleurs à l’origine de la formation d’hydrates de gaz rare ( Arn H²O). Dans cet exemple, les atomes d’argon se polarisent et sont attirés au voisinage du dipôle de la molécule d’eau.
L’énergie d’accélération d’une molécule
pénétrant dans le champ électrique est donnée par :
E pol = ½ µ E²
Avec µ = polarisabilité de la molécule
E = champ électrique
C’est donc uniquement le valeur moyenne du champ électrique au contact de la plaque électrostatique qui détermine l’énergie d’accélération des molécules. Un tableau donne l’énergie d’accélération d’une molécule pour quelques gaz, et l’échauffement correspondant.
Voir l'expérience hollandaise de décélération de molécules neutres
|
|
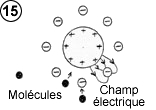
Imaginons une barre métallique chargée positivement à l’intérieur d’une grille métallique cylindrique reliée à la masse, c’est à dire une cage de Faraday. Celle-ci neutralise le champ électrique en dehors de la cage, grâce à la charge négative dont elle se dote par influence. Si une molécule de gaz se trouve loin de la cage, elle ne perçoit pas de champ électrique et il ne se passe rien. Par contre, si elle approche suffisamment de la grille, l’effet d’écran disparaît et la molécule se polarise sous l’effet du champ électrique résidant entre la barre et la grille (schéma ci-contre).
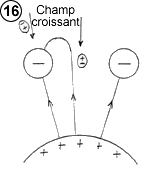
Dans le cas où elle pénètre entre deux barreaux de la grille, les électrons de la molécule sont attirés et son noyau repoussé. Mais comme les électrons sont plus près de la barre, et par conséquent dans un champ plus intense que le noyau, l’attraction des électrons l’emporte sur la répulsion du noyau : La molécule toute entière est attirée (schéma ci-contre). Dans le cas où elle s’approche d’un barreau de la grille, le noyau de la molécule est attiré et les électrons repoussés. Comme le noyau se trouve plus près de le grille et par conséquent dans un champ plus intense que les électrons, l’attraction du noyau l’emporte sur la répulsion des électrons. Là encore la molécule est attirée.
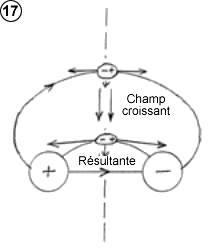
Si on prend encore le cas d’une molécule se déplaçant sur l’axe de symétrie d’un dipôle, c’est à dire perpendiculairement au champ électrique, (schéma 17), le noyau de la molécule est attiré vers la barre chargée négativement, et les électrons vers la barre chargée positivement, chacune de ces forces étant dirigée tangentiellement à la ligne de champ. Comme cette ligne est courbée, les deux forces d’attraction opposées ne sont donc pas parallèles, d’où une résultante de force dirigée vers le champ croissant. La pénétration d’une molécule dans un champ électrique a toujours pour effet de l’attirer vers le champ croissant, sans rapport avec la direction ni le sens du champ. Ce phénomène d’attraction par polarisation électrostatique d’un gaz est connu sous le nom de force de Debye, qui est par exemple à l’origine de la formation d’hydrates de gaz rares ( Arn H2O), avec production de chaleur résultant de l’énergie d’attraction entre molécules.
Paramètres de l’énergie d’attraction
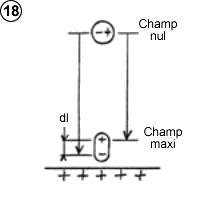
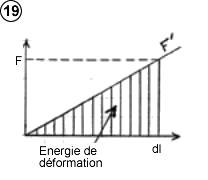
Lorsqu’une molécule polarisable, telle que SF6, pénètre dans un champ électrique, elle produit un dipôle qui induit une différence, en valeur absolue, d’énergie potentielle électrique acquise par les deux charges positives et négative. Cette différence d’énergie potentielle est le produit du décalage dl entre les charges (schéma ci-contre) par la force électrostatique F qui les sépare à cet endroit. Cependant une partie de cette énergie sert à déformer la molécule, de même qu’il faut de l’énergie pour actionner un ressort. Comme la force de déformation F’ varie linéairement avec dl (voir schéma 19) la force moyenne de déformation est donc ½ F, et l’énergie de déformation ½ F.dl.
Par conséquent, l’énergie restante de ½ F.dl est l’énergie d’attraction de la molécule sur la plaque. La polarisabilité de la molécule est µ = Q.dl/E (en Cm/Vm-1) donc Q.dl = µ.E d’autre part la force électrostatique qui sépare les charges F = Q.E donc F.dl = Q.E.dl = µ.E²
|
Energie d’attraction = ½ F.dl = ½ µ.E²
On retrouve cette formule par différents auteurs.
Autrement dit l’énergie d’attraction d’une molécule polarisable ne dépend que de la valeur du champ électrique en surface de la plaque, indépendamment de la longueur L d’attraction, c’est à dire l’épaisseur de la zone de champ variable à traverser, et indépendamment aussi de la valeur du gradient du champ électrique. En effet, pour un même champ électrique en surface, si l’on double l’épaisseur de la zône du champ variable, on double la longueur L d’attraction, mais en même temps on réduit de moitié le gradient du champ électrique et donc la force d’attraction. Par conséquent le travail d’attraction reste identique.
Le tableau ci-dessous donne l’énergie d’attraction (ou travail d’attraction) et la correspondance en degrés d’échauffement, pour quelques exemples de molécules de gaz pénétrant dans un champ de 5 x 108 V/m (500 KV/mm)
En supposant qu’elles proviennent d’une zône où le champ est nul. L’échauffement d’un 1°C équivaut à environ 2 x 10-23 Joules par molécule de gaz monoatomique, c’est à dire 3/2 K, avec K=1,38 x 10-23 Joule.
Pour une molécule polyatomique telle que SF6, l’énergie de translation de la molécule ne représente plus qu’environ la moitié de son énergie totale, l’autre moitié étant de l’énergie de rotation sur elle même. Pour estimer assez correctement l’échauffement d’une telle molécule, étant donné que seule l’énergie de translation est augmentée lorsque la molécule pénètre dans le champ électrique, il faudrait diviser par deux l’échauffement que l’on aurait s’il s’agissait d’une molécule monoatomique (qui ne possède que de l’énergie de translation).
|
gaz |
Polarisabilité (en Cm / Vm-1) |
Energie d’attraction avec 5 x 108V/m |
Degrés d’échauffement |
|
Argon Krypton Xenon SF6 |
1,85 x 10-40 2,95 x 10-40 4,66 x 1-40 7,4 x 10-40 |
2 x10-23 Joules 3,2 x 10-23 Joules 5 x 10-23 Joules 8 x 10-23 Joules |
1 Kelvin 1,6 K 2,5 K 4/2 K |
Voir l'expérience hollandaise de décélération de molécules neutres